| 楠山 譲二、松口 徹也 | 鹿児島大学大学院 医歯学総合研究科 発生発達成育学講座 口腔生化学分野 |
生物は生命活動を営む中で、多くのメカニカルストレス(圧力、張力、振動力などの力学的な刺激)を受けています。運動時には骨や筋肉、腱に対して負荷がかかっており、静止時でも心臓には拍動という刺激が常に加わっています。これらのメカニカルストレスは細胞によって受容され、細胞はその刺激に応じて体の様々な機能を調節しています。過不足なメカニカルストレスは様々な病気の原因となることも分かってきています。例えば、寝たきり状態などで運動による負荷が骨にかからなくなると、骨粗鬆症によって骨が脆くなる一因となります。このように生体が正常な営みを保つために、メカニカルストレスは非常に重要な因子の1つです。我々の研究室はこれらの知見を踏まえ、メカニカルストレスを応用して細胞の機能を制御するための基礎的研究を推進しており、いくつかの成果を挙げることができました。本トピックスではそれらの概要をお示しします。
1.LIPUS(低出力超音波)による間葉系幹細胞の分化調節機構
骨をつくる細胞である骨芽細胞は、元々、間葉系幹細胞と呼ばれる細胞に由来します。間葉系幹細胞は骨芽細胞以外にも、脂肪前駆細胞や軟骨芽細胞などへと分化する能力を持っており、間葉系幹細胞の分化のバランスが細胞種や組織量に大きな影響を与えます(図1)。我々は骨折治癒の促進に臨床応用されている超音波刺激であるLIPUSを用いることで、間葉系幹細胞の骨分化を促進し、脂肪分化を抑制できることを見出しました。
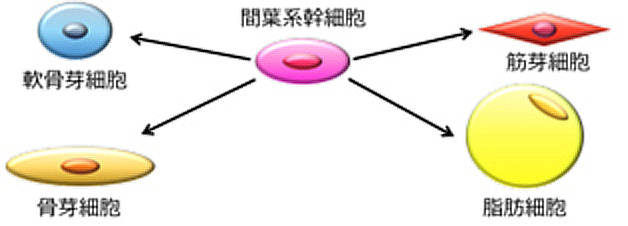
図1 間葉系幹細胞は、骨芽細胞、脂肪細胞、軟骨芽細胞、筋芽細胞に分化する能力を持つ。どの様な細胞に分化するかのバランスが、細胞数や組織量に大きな影響を与える。
マウス間葉系幹細胞株であるST2細胞にLIPUSを毎日20分間照射しながら、脂肪分化を誘導したところ、脂肪滴の形成や脂肪分化マーカー遺伝子の発現が抑制されました。一方で、LIPUSを照射しながら骨分化を誘導したところ、石灰化物の形成と骨分化マーカー遺伝子の発現が促進されました(図2)。
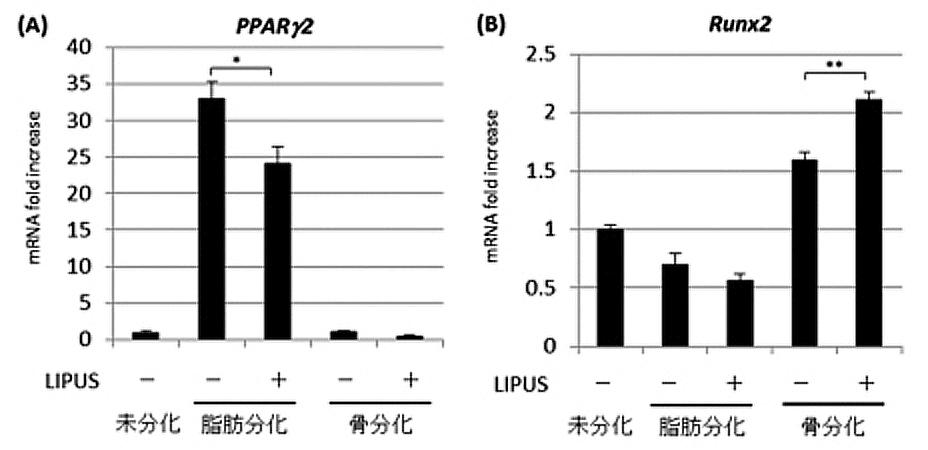
図2 (A) 間葉系幹細胞の脂肪分化によって誘導されるPPARγ2遺伝子の発現レベルはLIPUS照射によって抑制された。(B) 間葉系幹細胞の骨分化によって誘導されるRunx2遺伝子の発現レベルはLIPUS照射によって促進された。
LIPUSによる骨分化促進と脂肪分化抑制の機構を詳細に解析したところ、LIPUSは細胞骨格に係留するROCKと呼ばれるキナーゼ分子を活性化し、更に下流のキナーゼカスケード経路(Cot/Tpl2-MEK-ERK)によって細胞内にシグナルを伝達していることが分かりました。さらにLIPUSによって活性化したERKは、脂肪分化を促進し骨分化を抑制する作用を持つ転写因子であるPPARγ2のリン酸化を誘導していました(図3)。リン酸化修飾を受けたPPARγ2はその転写活性が抑制されることが知られており、これがLIPUSによる骨分化促進と脂肪分化抑制のキーとなる機構であると考えられます。
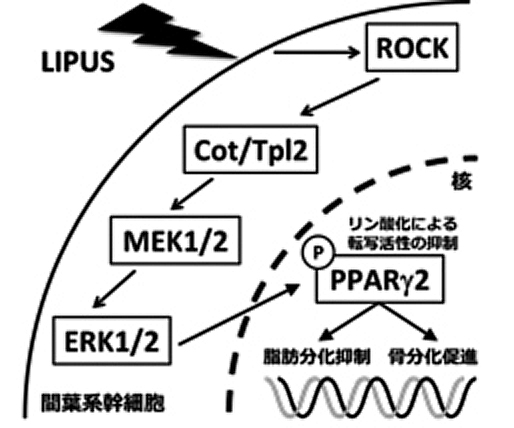
図3 LIPUS刺激は、ROCK-Cot/Tpl2-MEK-ERKシグナル経路を賦活する。活性化したERKは転写因子PPARγ2をリン酸化することで、転写活性を抑制する。その結果、脂肪分化が抑制され、骨分化が促進する。
LIPUSによるメカニカルストレスは出力や時間を安定して制御でき、照射も簡便であることから、細胞分化を制御する上で有用なツールであると言えます。また、本研究で明らかとなったシグナル伝達経路は、細胞のメカニカルストレス受容機構における新たな知見としても重要です。本研究は先端歯学スクール2012、第11回日本超音波治療研究会で最優秀賞を授与され、また、本年11月には楠山が学長表彰を受けるなど、学内外で高く評価されています。
2.LIPUSによる骨芽細胞のLPS誘導性炎症反応の抑制機構
骨芽細胞は、炎症による免疫応答においても重要な細胞です。グラム陰性菌の細胞膜成分であるLPS(リポ多糖)の作用によって、骨芽細胞は破骨細胞を活性化するRANKLや炎症性細胞を引き寄せるケモカインを強く発現します。そのため歯周炎や炎症性関節炎において、骨芽細胞は骨吸収や炎症反応の増強させる要因となり得ます。我々はLIPUSを骨芽細胞に照射することで、LPSによる炎症反応を抑制できることを見出しました。
マウス骨芽細胞株であるMC3T3-E1細胞にLPSを施すと同時にLIPUSを照射し続けると、LPSによるケモカインCXCL1やCXCL10、RANKLの発現の上昇がブロックされました(図4)。また、LPSによって誘導されるシグナル分子群や転写因子群の活性化についても、LIPUSを照射することでその活性を抑えることができました。
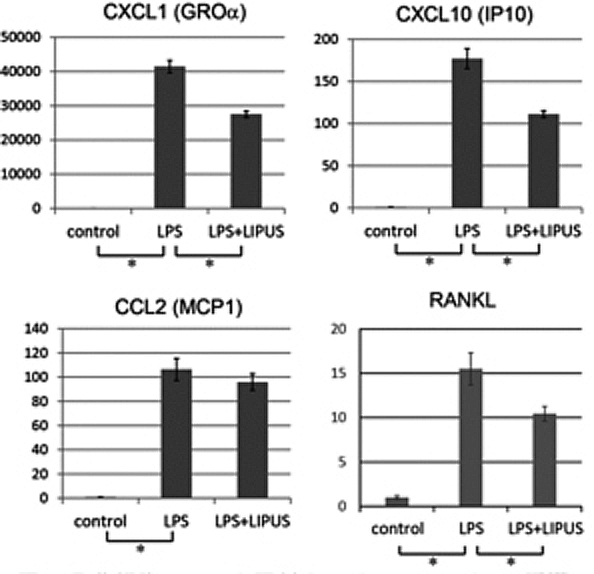
図4 骨芽細胞にLIPUSを照射することで、LPSによって誘導されるケモカインCXCL1, CXCL10やRANKLの発現を抑えることができた。
本研究結果は、メカニカルストレスを応用することによる炎症性骨疾患の新しい治療法の基盤となり得るものです。本研究は主に、当講座の学生ゼミ生であった中尾寿奈さん(H20入学)と藤居泰行君(H19入学)が中心になって遂行し、日本歯科医師会/デンツプライ主催SCRPや日本歯科医学総会などで学生発表を行いました。また本研究成果は、最近、骨代謝学の国際的リーディングジャーナルの1つであるBONE誌に掲載されました。
3.メカニカルストレスのシグナル伝達におけるΜyD88とIL-1βの機能的役割
歯科矯正臨床においては、メカニカルストレスとそれに伴って生じる炎症反応を適切に制御することで、患者の負担を最小限にしながら歯の移動を行うことが必要です。我々は歯科矯正学分野の前田綾先生との共同研究によって、メカニカルストレスのシグナル伝達経路に、炎症に関わる分子であるMyD88とIL-1βが機能的役割を果たしていることを明らかにしました(一部の内容はJournal of Dental Research誌に発表済み)。
炎症反応のアダプター分子であるMyD88のノックアウトマウスから採取した骨芽細胞は、圧刺激によるケモカインの発現が著しく減少していました。また、炎症性サイトカインであるIL-1βと圧刺激を同時に施すと、野生型の骨芽細胞ではケモカインの発現が更に上昇しましたが、MyD88ノックアウトマウス由来の骨芽細胞においては変化が認められませんでした。さらに、野生型骨芽細胞の構成的なIL-1βの産生を中和抗体で阻害したところ、圧刺激によるケモカインの発現レベルは低下しました。これらの結果から、IL-1βによるMyD88を介した経路が、メカニカルストレスのシグナル伝達に影響を与えていると考えられます(図5)。本研究結果は、メカニカルストレスの適切な利用のために、MyD88やIL-1βなどの炎症に関わる分子を制御することが必要である実証的データであると考えられます。
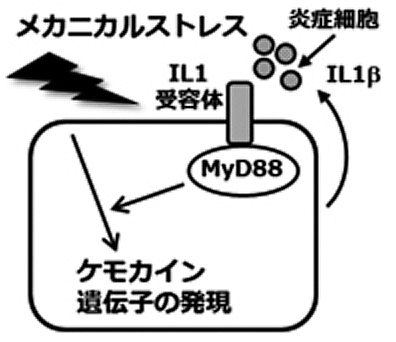
図5 メカニカルストレスによるケモカインの発現は、炎症細胞や自身によって分泌されるIL-1βと、それによって活性化されるMyD88を介したシグナル経路によって増強される。
以上のように、メカニカルストレスは細胞の分化や免疫応答に深く関与するとともに、メカニカルストレスを応用することで、様々な細胞機能を調節できる可能性が示唆されます。我々はこれらの研究成果を踏まえ、メカニカルストレスの実践的な利用を目指した研究を更に推進していきます。