癌骨破壊病変の制御に関する研究 / 研究者:奥井 達雄
大学院博士課程から一貫して骨代謝、特に癌骨破壊病変の制御に関する研究をおこなっております。その過程で生じた疑問である骨転移性癌における癌性骨痛が癌の病態に与える分子生物学的メカニズムの探求、ならびに制御を現在の主研究テーマとしております。
癌治療はロボット支援による手術術式の進歩、分子標的治療薬の開発、使用にもかかわらず、国内の年間死亡者は約40万人であり全死亡原因の30%を占めております。癌は神経浸潤(PNI)を示し、このPNIは生命予後の不良因子であることが知られていますが、この癌と神経の相互作用に関する検討はほとんどなされておりません。これは神経電気生理学的な実験手技と癌分子生物学的な実験手技の差異から生じるピットフォールによるものであります。
私は岡山大学口腔外科(病態系)にて10年以上にわたり癌骨破壊病変のメカニズムに対する研究を行ってまいりました。その後、米国インディアナ大学の米田俊之教授、David Roodman教授の研究室において乳癌骨転移による癌性骨痛に関する検討を行ってまいりました。
私はこれまでの癌骨破壊病変制御の研究を、さらに発展させ、癌と知覚神経の相互作用を検討するBone Neuro Oncologyという概念を提唱し、基礎的、臨床的検討を継続する所存でございます。
研究テーマ:① 癌性骨痛の分子生物学的検討
骨指向性悪性腫瘍は高頻度に骨に浸潤、転移し骨痛により患者のQOLを著しく低下させます。癌が骨へ進展する過程には破骨細胞による骨破壊が必須ですが骨膜、骨髄に分布し血管新生、骨形成を制御する知覚神経線維の増生と、その興奮によって引き起こされる骨痛が、癌の増大に果たす役割は全く解明されていません。
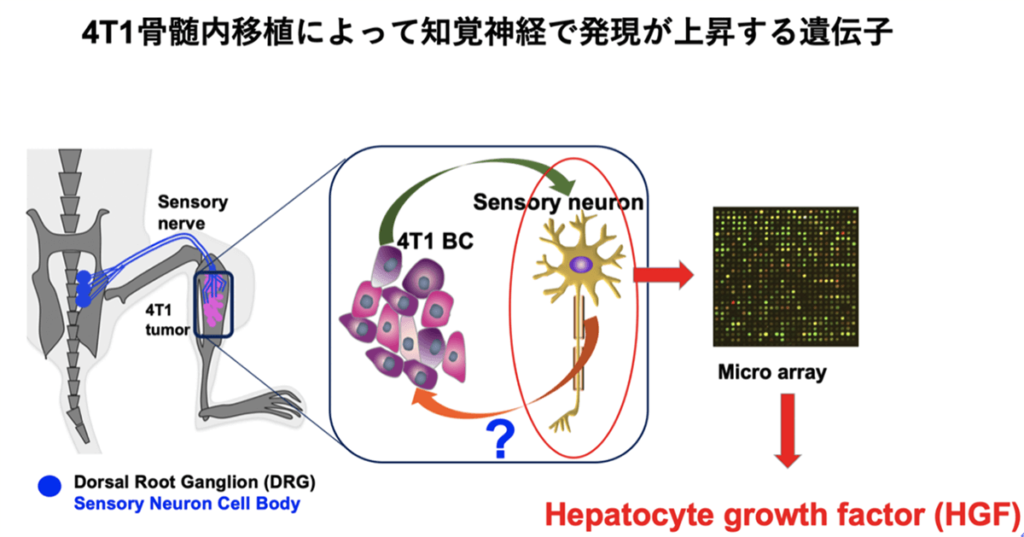
癌骨破壊病変において、癌細胞ならびに破骨細胞は細胞外にプロトンを排出し周囲の環境を酸性に偏向させます。骨内での知覚神経末端は酸感受性受容体(TRPV1)を特異的に発現しており、それらの刺激を介してがん性骨痛が惹起されます。われわれはその際、坐骨神経を結紮切断した除神経マウスでは正常マウスと比べがん性骨痛が誘発されにくく、同時に癌の脛骨骨髄から肺への転移が抑制されることを発見しました。さらに癌骨髄移植モデルマウスでは骨髄中の神経軸索伸張が増強される事を見いだし癌細胞が産生する乳酸、破骨細胞が産生するプロトンが骨髄内の神経軸索の伸長、知覚神経の興奮を介してがん性骨痛を誘発することをあきらかにしております(下図)
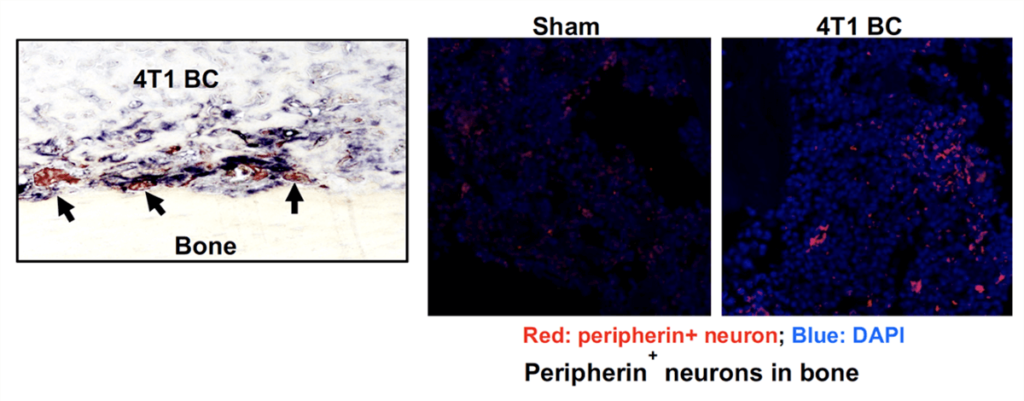
(図左:4T1 乳癌細胞骨髄移植モデルマウスの骨切片. 腫瘍細胞の増加に伴い破骨細胞(赤紫)が出現し骨吸収を促進させる。破骨細胞近傍に神経軸索(紫)が誘導されていることが分かる。 図右 4T1骨髄移植モデルマウス骨髄切片の蛍光免疫染色. 4T1 移植マウス骨髄では知覚神経マーカーであるperipherin(赤)陽性神経繊維の増加を認める。
われわれは更に癌骨破壊病変の酸性環境によって活性化した知覚神経をDNAアレイにて検討し、ある種の増殖因子が増加することを明らかにしました(下図)。またこの増殖因子の阻害薬を癌骨破壊モデルマウスに投与すると癌の骨から肺への二次転移が抑制されること明らかにしました。
この結果は、癌骨破壊病変に特徴的な酸性環境が癌性骨痛を誘発するだけで無く、癌細胞増殖を促進させるといういわゆるVicious Cycleを形成している事を示唆します。
癌性疼痛は精神的に患者のQOLを低下させるものと考えられているが、われわれの研究の進捗によって、癌性疼痛が分子生物学的に癌の増大を促進することが明らかになれば疼痛をターゲットとした全く新たな癌分子標的治療の礎となる可能性があります。